Viti e Riso TEA vandalizzate
Nella notte tra il 12 e il 13 febbraio 2025, le colture di viti TEA del progetto di ricerca della docente di Genetica Agraria dell’Università di Verona Sara Zenoni sono state sradicate. Questo gesto rappresenta il secondo atto vandalico contro la scienza dopo quello di Giugno 2024 sul RIS8imo.

Questo recente evento ha suscitato l’indignazione del mondo scientifico e agricolo. L’obiettivo della ricerca era quello di ottenere piante meno suscettibili alla peronospora (malattia causata dall'oomicete Plasmopara viticola), così da ridurre l’uso massiccio di fungicidi: pur occupando solo il 2% del suolo agricolo europeo, le vigne sono responsabili del 40% dell’impiego di queste sostanze. L’innovazione proposta non prevedeva l’introduzione di DNA estraneo, ma l’eliminazione di uno o pochi geni che rendono le piante vulnerabili alla malattia, mantenendo intatta l’identità della varietà Chardonnay. Mario Pezzotti, docente di Genetica Agraria, ha definito il gesto un grave danno alla ricerca, mentre Silvio Salvi, presidente della Società di Genetica Agraria, lo ha definito un "atto oscurantista autolesionista".
Il ministro dell'Agricoltura Francesco Lollobrigida ha espresso solidarietà ai ricercatori, ribadendo l'importanza dell'innovazione in agricoltura. Cia, Confagricoltura, Coldiretti e Copagri hanno anch'essi condannato l'attacco, sottolineando il valore delle TEA per una viticoltura più sostenibile, meno dipendente dai fitofarmaci e più resiliente ai cambiamenti climatici.
L’atto vandalico non ha solo interrotto una sperimentazione scientifica innovativa, ma ha anche messo in luce una contraddizione profonda: chi si oppone a certe tecnologie in nome della tutela della natura rischia di danneggiare proprio quegli strumenti che potrebbero salvaguardare il futuro dell’agricoltura.
Distruggere questi progetti significa bloccare il progresso e privarci di alternative che potrebbero ridurre l’uso di fitofarmaci, proteggere l’ambiente e preservare la salute del territorio.
Un approfondimento sulle due colture geneticamente modificate
Le due colture vittime di orrendi atti vandalici erano un variante di Vite Chardonnay resistente alla Peronospora e una variante di Riso Arborio resistente invece al Brusone (malattia causata dal fungo Pyricularia oryzae), entrambe ottenute tramite tecniche di editing genetico che permettono di modificare la piante senza utilizzare DNA estraneo alla pianta stessa.
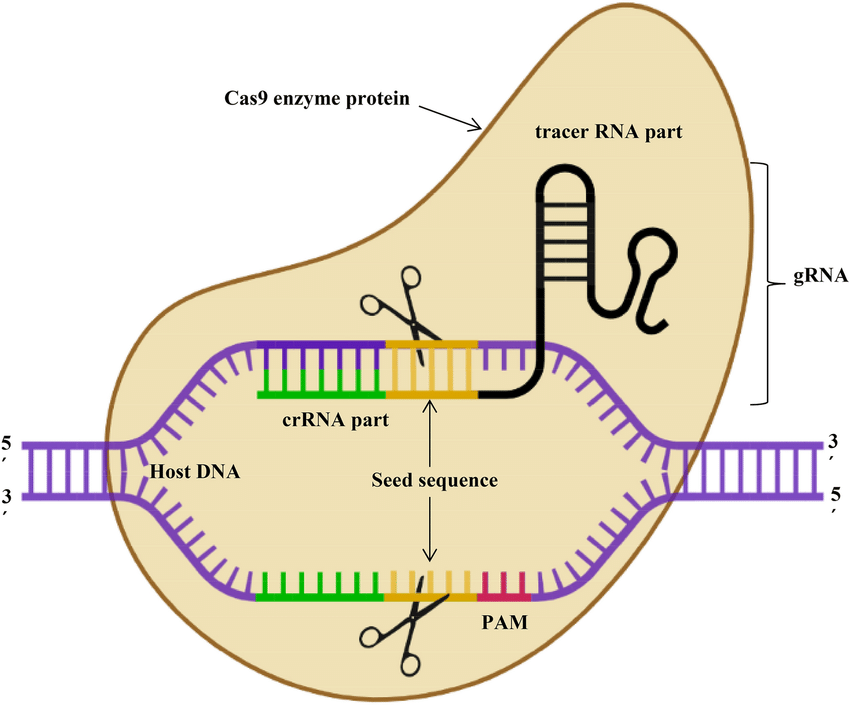
Entrambe le colture sono state ottenute tramite l’utilizzo della tecnica di editing genetico CRISPR/Cas9.
È da notare che l’approccio CRISPR/Cas9, per il quale Emmanuelle Charpentier e Jennifer A. Doudna hanno ricevuto il premio Nobel per la Chimica nel 2020, si basa su un meccanismo puramente biologico che fa riferimento all’acquisizione di immunità da parte dei batteri nei confronti dei virus che li infettano, i fagi.
Molti batteri (e archaea) possiedono infatti un sistema immunitario che fornisce protezione specifica contro virus e plasmidi. Questo sistema si basa su una regione (locus) del genoma batterico contenente brevi ripetizioni palindromiche regolarmente interspaziate, note come CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats). Nel DNA, una sequenza palindromica è una regione in cui la sequenza di basi 5′-3′ di un filamento è identica alla sequenza 5′-3′ del filamento complementare, ad esempio:
5′ AAGGCCTT 3′
3′ TTCCGGAA 5′
Nei loci CRISPR, queste ripetizioni sono intervallate da sequenze che derivano dal DNA estraneo di virus batterici. A monte del locus CRISPR si trovano geni che codificano per proteine chiamate Cas (CRISPR-associated proteins), nucleasi in grado di tagliare il DNA in un punto interno (endonucleasi). Il meccanismo antivirale funziona in questo modo: quando un fago inietta il suo DNA nella cellula, può ucciderla o, in alcuni casi, un frammento del suo DNA viene incorporato nel locus CRISPR come memoria immunitaria ereditaria. Quando il batterio o la sua progenie incontrano nuovamente un patogeno, scatta la trascrizione del locus CRISPR (oltre che delle proteine Cas), generando un RNA che prende il nome di pre-crRNA. Quest’ultimo, grazie ad una componente del complesso Cas, viene tagliato in corrispondenza dei vari spacers, utilizzando le sequenze palindromiche. I frammenti di RNA che ne derivano (crRNA) sono tutti complementari a sequenze dei vari virus incontrati dal batterio, e si legano a Cas. Se il virus infettante corrisponde ad un virus già “memorizzato”, un crRNA riconosce per complementarietà il DNA virale, consentendo alle proteine Cas di tagliarlo con una rottura a doppio filamento, impedendo così la replicazione del virus.
Ti è piaciuto questo articolo? Supporta la nostra associazione: associati oppure effettua una donazione.
Il tuo sostegno è per noi importante!
Le proteste in Turchia e l’arresto del sindaco di Istanbul: un nuovo punto di non ritorno per la democrazia?
di M. Isoni
Stanno destando scalpore le immagini provenienti dalla Turchia, dove da ormai più di due settimane…
Bergoglio tra luci e ombre
di L. Allevi
Il 21 aprile 2025 Papa Francesco è deceduto all'età di 88 anni nella sua residenza presso la Casa…
Gli errori di Trump: l'IVA non è un dazio
di M. Poloni
Mentre si trascinano le giornate della “guerra commerciale più stupida della storia”, con tensioni…

