L'atomo: il non più indivisibile
di Giulio Cervo
Tutti noi abbiamo ben presente la classica immagine di un atomo: una struttura centrale composta da “palline” di due colori differenti (solitamente rosse e blu), circondata da altre palline più piccole (grigie) che le ruotano attorno. Ma com’è fatto realmente un atomo, e come si è arrivati a conoscerlo nel suo profondo? In questo articolo cercherò di spiegare la struttura dell’atomo in maniera semplice, ma comunque tecnica, illustrando le principali scoperte scientifiche della storia che hanno portato alla realizzazione degli attuali modelli atomici.
Tutto nacque nell’antica Grecia. Tra i filosofi che si domandavano il perché di ciò che li circondava e che cercavano la loro risposta in un principio primo alla base di tutta la vita e l’esistenza (l’arché), Democrito ipotizzò che, indipendentemente da materiale, forma e stato, qualunque oggetto potesse essere ridotto ad un insieme di elementi tutti uguali tra loro e non scomponibili in parti più semplici: da qui nacque il termine atomo, che significa appunto “indivisibile”. Secondo Democrito, in base a come si aggregano tra di loro, gli “indivisibili” danno forma ai vari elementi e materiali presenti in natura e tangibili all’essere umano, ma, non avendo le tecnologie adatte, quella di Democrito rimase solo un’idea per molti secoli. Benché sia ormai dimostrato che l’atomo è un sistema complesso costituito da diverse parti e che quindi non è più “indivisibile”, il nome è stato conservato fino alla moderna teoria atomica.
Col passare dei secoli, infatti, le seguenti nozioni erano state rese note:
- Ad ogni elemento chimico corrisponde un tipo di atomo;
- Una mole di qualsiasi elemento contiene esattamente un numero di Avogadro di atomi (6.022 x 1023);
- Gli atomi sono elettricamente neutri anche se contengono cariche positive e negative al loro interno;
- Le cariche negative dell’atomo sono dovute alle stesse particelle, gli elettroni;
- La massa dell’atomo è associata approssimativamente alla carica positiva;
- L’ordine di grandezza degli atomi è di 10-10 m (1 Ångstrom)
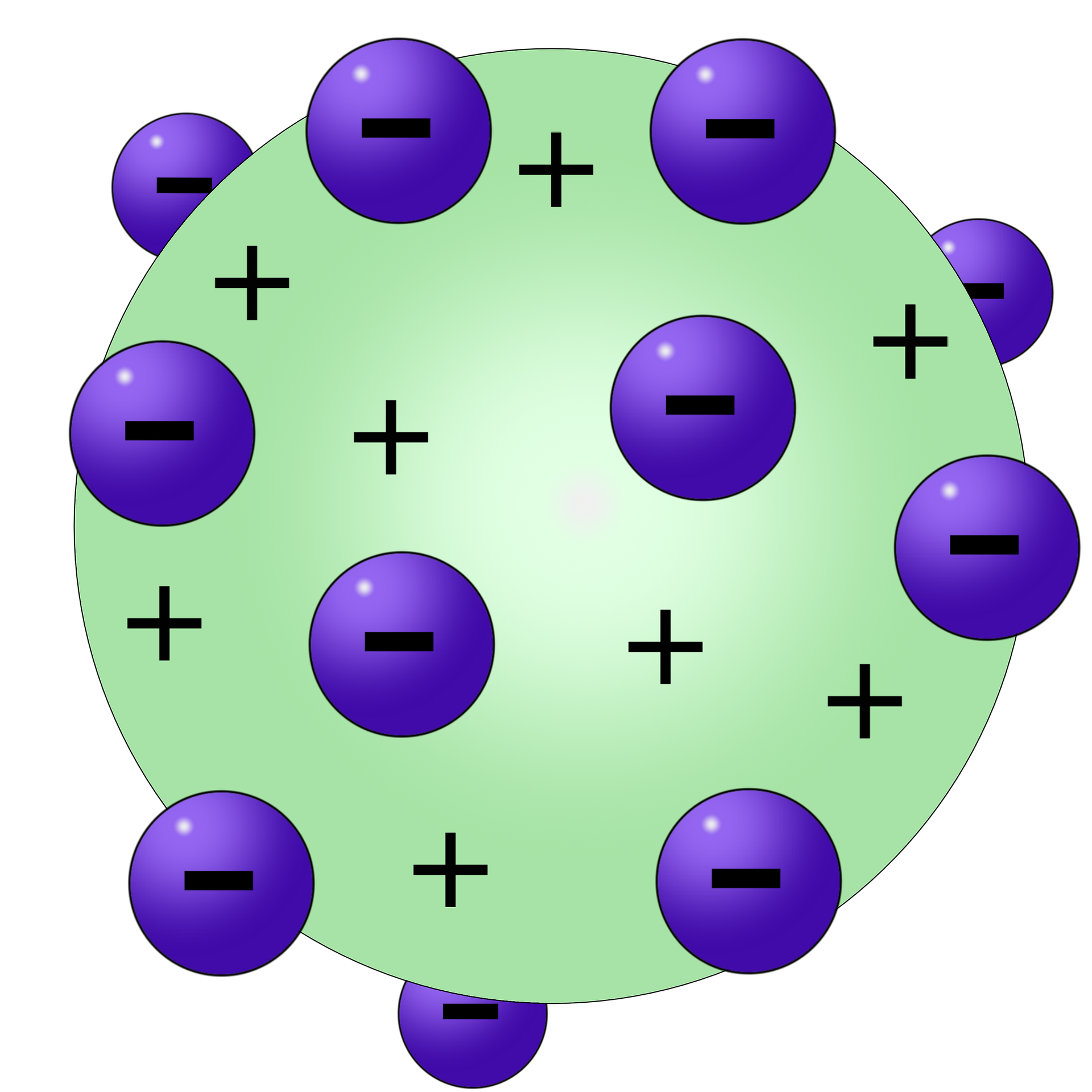
Il modello atomico di Thomson
Conosciuto anche come modello “a panettone”, la struttura atomica ipotizzata dal fisico Joseph John Thomson nel 1904 prevedeva che l’atomo altro non fosse se non una sfera di uniforme densità delle dimensioni di 1 Å caricata positivamente e all’interno della quale le cariche negative sono equamente distribuite in un continuo equilibrio tra forze elettriche di repulsione e attrazione. In questo modello il numero di elettroni corrisponde al numero atomico Z (ossia il numero delle cariche elementari dell’atomo allora conosciute) e grazie ad esso viene spiegata la natura degli ioni: essi sono semplicemente atomi che hanno perso uno o più elettroni.
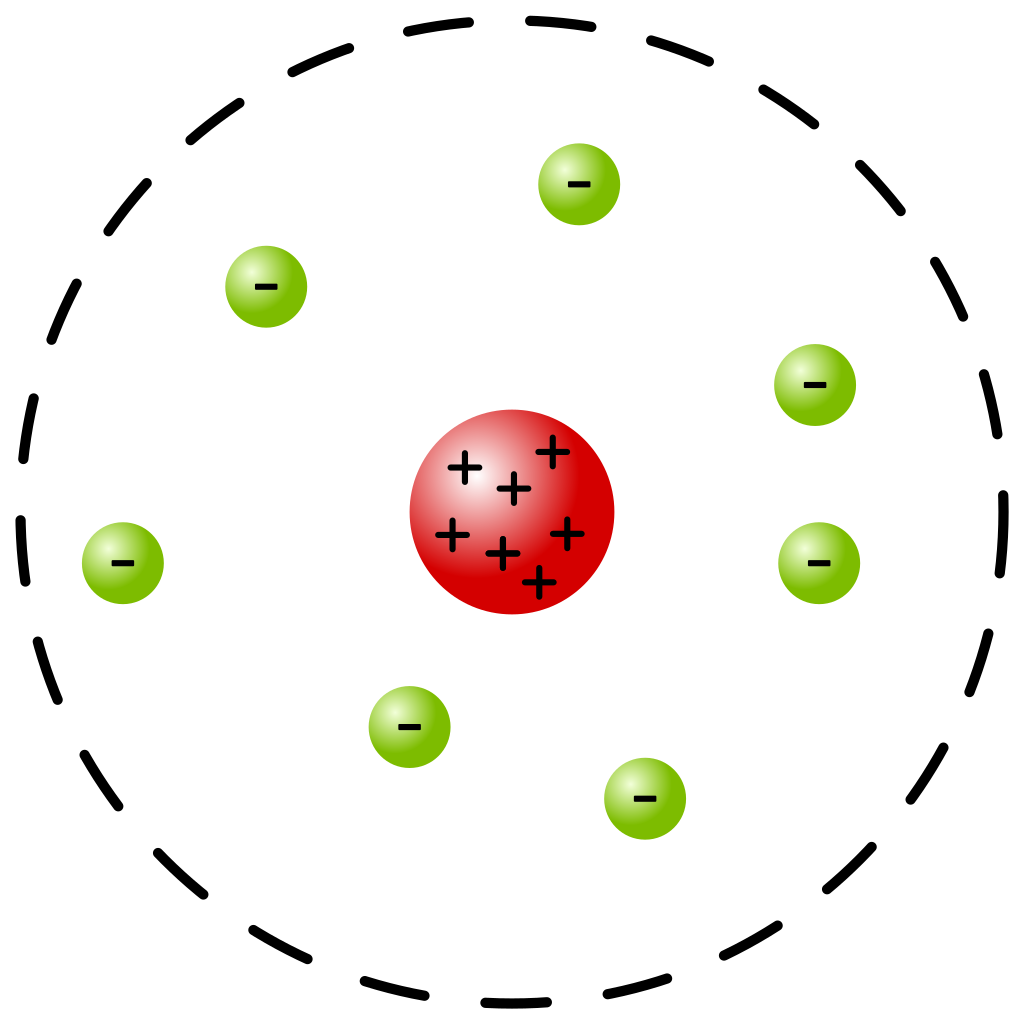
Il modello atomico di Rutherford
L’ideazione di questo modello avvenne dall’analisi di un esperimento condotto dal fisico Ernest Rutherford nel 1909. Tale esperimento consisteva nel bombardare un sottilissimo foglio di oro con delle particelle α (elettricamente positive) e studiare la deviazione di traiettoria di queste ultime. Seguendo il modello atomico di Thomson, le particelle α, interagendo con il foglio d’oro, verrebbero elettricamente respinte sempre di più dalle sfere atomiche (anch’esse elettricamente positive) finché, una volta all’interno delle sfere stesse, tale forza viene ridotta. A causa di queste forze elettriche, le particelle verrebbero deviate dalla loro traiettoria originale; tuttavia, dai calcoli del modello di Thomson, la probabilità che una particella α venga deviata di un angolo maggiore di 90° è estremamente bassa. Dai risultati dell’esperimento si verificò invece che le particelle deviate di più di 90° erano significativamente maggiori delle stime, rilevando addirittura particelle completamente rimbalzate all’indietro.
Per giustificare tale effetto, Rutherford ipotizzò che, invece di una sfera omogenea caricata positivamente, l’atomo fosse composto da un nucleo centrale nel quale tutta la carica positiva era concentrata. Da tale modello atomico vennero esposte le seguenti considerazioni:
- Ogni atomo contiene una particella carica positivamente, il nucleo atomico, le cui dimensioni sono molto più piccole delle dimensioni dell’atomo intero, ma la cui massa è approssimativamente uguale alla massa di tutto l’atomo;
- La carica elettrica del nucleo atomico è uguale (ma di segno opposto) alla somma delle cariche elettriche degli elettroni, ossia Ze;
- Gli elettroni orbitano attorno al nucleo attraverso orbite circolari i cui diametri sono dell’ordine delle dimensioni dell’atomo intero (circa 1Å);
- La tavola periodica degli elementi viene ottenuta correttamente seguendo il numero atomico (ridefinito poi come quantità di cariche positive dell’atomo, ossia il numero di protoni) degli elementi al posto del loro peso atomico;
- Confrontando le dimensioni del nucleo con quelle dell’atomo nel suo intero, si può dedurre che l’atomo è composto principalmente da spazio vuoto.
Tuttavia, benché il modello atomico di Rutherford fosse più complesso e dettagliato di quello di Thomson, esso aveva un grande problema. Se infatti si considera un modello atomico (nucleo – elettroni) analogo ad un modello planetario (stella – pianeti), un elettrone orbitante attorno al nucleo su un’orbita chiusa, trattandosi di una particella accelerata, dovrebbe continuamente emettere una radiazione elettromagnetica con frequenza pari alla frequenza di rotazione dell’elettrone stesso attorno al nucleo. Ma ciò non si verifica nella realtà. Non di meno, l’elettrone, emettendo continuamente una radiazione elettromagnetica, dovrebbe perdere energia continuamente e, come conseguenza, la risultante orbita, anziché essere circolare, dovrebbe essere una spirale fino al collasso totale dell’elettrone sul nucleo.
Se ciò avvenisse, le dimensioni del nucleo e dell’atomo non sarebbero più diverse ma coinciderebbero (cosa non vera) e, soprattutto, il tempo di collasso di un elettrone sul proprio nucleo sarebbe talmente breve (si parla di circa 10-10 s), che l’universo che conosciamo non esisterebbe se non per una durata di qualche istante.
Se si vuole considerare un altro problema un po’ più specifico, si può ragionare considerando l’ipotetica frequenza di emissione degli atomi dovuta all’orbita a spirale degli elettroni. Basandosi sul modello così descritto, la frequenza di emissione degli atomi dovrebbe essere continua in quanto pari alla frequenza di rotazione degli elettroni, i quali a loro volta, a causa della loro orbita a spirale, cambiano frequenza di rotazione continuamente. Sperimentalmente, tuttavia, si nota che un gas eccitato emette onde elettromagnetiche solo a ben specifiche frequenze (spettro a linee) che ne caratterizzano l’elemento stesso indipendentemente dallo stato di eccitazione. Una tale caratteristica sperimentalmente dimostrata è in netto contrasto con il modello atomico di Rutherford.
Il modello atomico di Bohr
Lo studio dell’atomo portò alla nascita della meccanica quantistica, e il modello atomico di Bohr può essere considerato come uno dei tasselli iniziali di questa nuova teoria. Basandosi sul modello atomico di Rutherford e sull’analisi degli spettri di emissione degli atomi, Niels Bohr nel 1913 propose il proprio modello dell’atomo di idrogeno partendo da due ipotesi:
- Un elettrone si muove a velocità costante su un’orbita circolare attorno al nucleo e attratto da esso tramite la forza di Coulomb;
- Tale moto è possibile solo su circonferenze ben precise, le “orbite quantistiche” definite da raggi dipendenti da valori ben precisi di momenti angolari degli elettroni stessi, ossia ogni elettrone può muoversi su orbite il cui momento angolare è multiplo di ħ = h/2π (dove h è la costante di Plank pari a 6,626 x 10-34 J s); il momento angolare degli elettroni è dunque quantizzato.
Da queste ipotesi si può definire il raggio dell’orbita dell’elettrone di un atomo di idrogeno, il cosiddetto raggio di Bohr: aB = 0.53 Å. Tale raggio rappresenta l’orbita fondamentale dell’atomo di idrogeno ed è definita dal parametro n = 1, dove n è il numero quantico principale. Al valore n = 1 dunque corrisponderà un valore specifico di energia dell’orbita e le orbite successive (corrispondenti a n = 2, 3, … i) avranno tutte valori ben precisi (quantizzati) di energia.
Come conseguenza delle ipotesi di cui sopra, il modello atomico di Bohr prevede che un elettrone possa radiare energia solo passando da un’orbita consentita a un’altra di valore energetico inferiore.
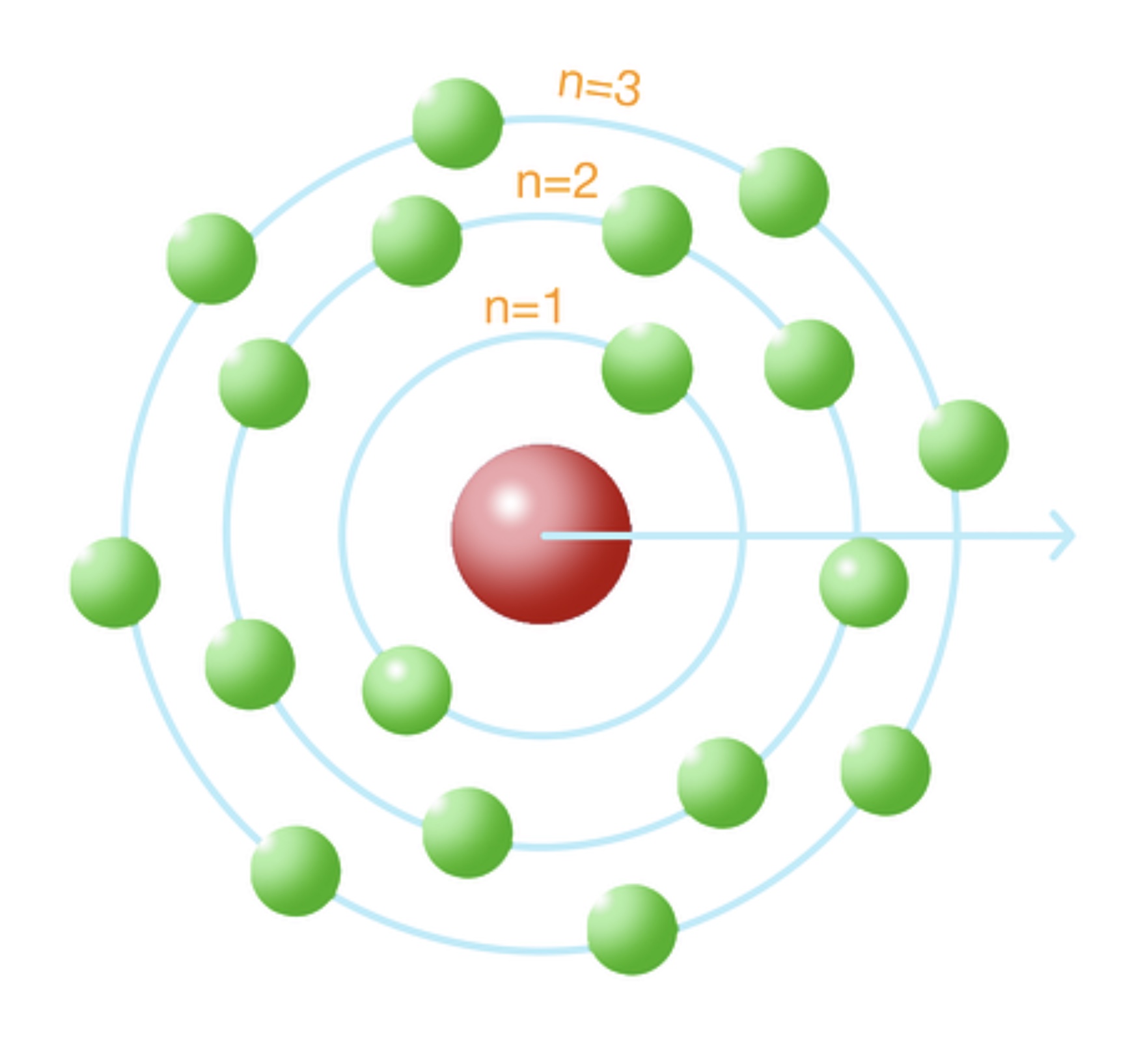
La correzione di Bohr-Sommerfeld
Il modello di Bohr superava le problematiche del modello di Rutherford, tuttavia, con l’innovazione tecnologica, una nuova scoperta fu fatta analizzando gli spettri di emissione e di assorbimento degli atomi. Avendo quantizzato le orbite degli elettroni, e quindi anche le corrispondenti energie, si poté verificare che ogni atomo è caratterizzato da specifiche bande di emissione/assorbimento di energia (corrispondenti appunto alle energie delle orbite dei propri elettroni). Riassumendo, ad ogni valore di n di ogni atomo di ogni elemento corrisponde un’energia specifica osservabile nello spettro dell’atomo stesso.
Poco dopo la pubblicazione del modello di Bohr, si scoprì che ad ogni valore di n, invece di riscontrare un unico valore di energia corrispondente, ce n’erano di più. Tali valori erano molto vicini tra di loro sicuramente, ma in generale lo spettro degli atomi si scoprì essere più dettagliato di quanto studiato fino ad allora. Da qui nacque la cosiddetta struttura fine dello spettro degli atomi.
La spiegazione di tale osservazione fu attribuita al fatto che ogni elettrone orbitante nella sua specifica orbita (a un dato numero quantico principale n), abbia diversi numeri quantici corrispondenti a diversi gradi di libertà, in funzione dei quali l’energia corrispondente dell’elettrone stesso si discosta leggermente dal singolo valore predetto da Bohr.
In sostanza, Sommerfeld scoprì che i gradi di libertà che un elettrone può assumere sono tre, corrispondenti ad altrettanti numeri quantici:
- Numero quantico principalen: stesso significato del modello di Bohr, può assumere solo lavori interi positivi e rappresenta l’orbita (il livello energetico) dell’elettrone;
- Numero quantico orbitale (o azimutale/angolare) l: rappresenta il momento angolare dell’elettrone, che adesso può muoversi in orbite sia circolari che ellittiche e può assumere valori interi positivi;
- Numero quanticomagneticom: può assumere valori sia positivi che negativi e rappresenta l’inclinazione del pianodove giace l’orbita dell’elettrone.
In definitiva, questi sono i principali modelli atomici proposti agli inizi del ‘900 e che portarono pian piano alla nascita della meccanica quantistica. Ulteriori passi avanti nella modellizzazione dell’atomo sono stati fatti, ma hanno richiesto ulteriori scoperte fatte negli anni successivi e che verranno esplorate in prossimi articoli.
Ti è piaciuto questo articolo? Supporta la nostra associazione: associati oppure effettua una donazione.
Il tuo sostegno è per noi importante!